Teoria VSEPR - Didattica delle Scienze



Menu principale:
Teoria VSEPR
Punti principali della teoria VSEPR
L'ipotesi di questa teoria è che la distribuzione dei legami attorno ad un atomo dipende dal numero totale di coppie di elettroni, sia di non legame (lone pair = coppie solitarie) che di legame (bonding pair), che lo circondano: queste coppie si dispongono nello spazio geometrico in modo da minimizzare la loro reciproca repulsione. Le repulsioni tra due coppie di non legame sono maggiori che tra una coppia di non legame e coppia di legame a loro volta maggiori delle repulsioni tra due coppie di legame.
In sintesi:
Le coppie di elettroni nel guscio di valenza dell'atomo centrale si respingono a vicenda.
Queste coppie di elettroni tendono a occupare la posizione più adatta per minimizzare la repulsione, massimizzando quindi lo spazio interposto tra gli elettroni.
Il guscio di valenza è considerato come una sfera sulla cui superficie sono localizzati gli elettroni, che manterranno la massima distanza tra loro.
Un legame multiplo è considerato come una singola coppia di elettroni, quindi due o tre coppie di elettroni di un legame multiplo si considerano come una super coppia di elettroni.
Il modello VSEPR è applicabile quando due o più strutture di risonanza possono rappresentare una molecola.
Si prendono in considerazione tre tipi di repulsione tra gli elettroni di una molecola:
La repulsione tra coppia solitaria e coppia solitaria
La repulsione tra coppia solitaria e coppia di elettroni di legame
La repulsione tra coppia di elettroni di legame e coppia di elettroni di legame
La teoria VSEPR è spesso comparata e messa in contrasto con la teoria del legame di valenza, che definisce la geometria molecolare tramite l'analisi degli orbitali che sono energeticamente adeguati per intraprendere un legame. La teoria del legame di valenza riguarda la formazione di legami sigma e pi greco.
La teoria degli orbitali molecolari è invece un altro modello che consente di prevedere la disposizione spaziale di atomi ed elettroni che costituiscono molecole e ioni poliatomici.
La teoria VSEPR è stata tuttavia spesso criticata per non avere riscontri quantitativi, anche se strutturalmente accurati per le molecole formate da legami covalenti.
Nella teoria VSEPR si utilizza il metodo AXE per il conteggio degli elettroni. La sigla AXE intende per A l'atomo centrale che è sempre 1; per X il numero di legami sigma tra l'atomo centrale e gli altri atomi; per E in numero di lone pair. La somma di X ed E, definita come numero sterico, è associata anche al numero totale di orbitali ibridati considerati dalla teoria del legame di valenza.
| AXE | Disposizione degli elettroni | Forma | Esempi di Molecole | Esempi della Geometria VSEPR |
 |  | Forma lineare | BeCl2 HgCl2 CO2 |  |
 |  | Forma angolare | NO2- SO2 O3 |  |
 |  | Forma angolare | H2O OF2 |  |
 |  | Forma lineare | XeF2 I3- |  |
 | 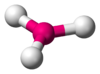 | Trigonale planare | BF3 CO32- NO3- SO3 |  |
 |  | Piramidale trigonale | NH3 PCl3 SO32- |  |
 |  | A "T" (anche leggermente distorta) | ClF3 BrF3 |  |
 |  | Tetraedrica | CH4 PO43- SO42- ClO4- BF4- |  |
AX4E1 |  | Ad "altalena" (anche leggermente distorta) | SF4 |  |
 |  | Quadrata planare | XeF4 IF4 - | |
 |  | Bipiramidale trigonale | PCl5 |  |
 |  | Piramidale a base quadrata | ClF5 BrF5 |  |
 |  | Bipiramidale a base quadrata (Ottaedrica) | SF6 UF6 |  |
| AX5E1 |  | Pentagonale Planare | XeF5- |  |
 |  | Bipiramidale a base pentagonale | IF7 |  |








