Ph e cavolo rosso - Didattica delle Scienze



Menu principale:
Ph e cavolo rosso
pH e cavolo rosso
Il cavolo rosso
Gli antociani
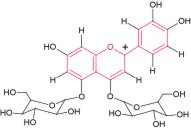 Il nocciolo è formato da tre anelli di atomi di carbonio. È l’alternanza regolare di legami singoli e doppi estesa su tutti gli anelli a produrre il colore di queste sostanze quando esse sono illuminate dalla luce solare.
Il nocciolo è formato da tre anelli di atomi di carbonio. È l’alternanza regolare di legami singoli e doppi estesa su tutti gli anelli a produrre il colore di queste sostanze quando esse sono illuminate dalla luce solare.Viraggio degli antociani
Il colore delle antocianine sciolte in acqua dipende dall’acidità della soluzione .Ecco perché alcune piante hanno fiori di colore diverso in funzione dell’acidità del terreno in cui sono coltivate. Il cambiamento di colore prodotto da una variazione di acidità si dice viraggio. Dal punto di vista dell’acidità la sostanza di riferimento è l’acqua. L’acqua pura contiene piccole quantità di ioni H+ e di ioni OH-; poiché esse sono uguali fra loro l'acqua pura è neutra. Le sostanze che fanno aumentare la concentrazione di ioni H+ si chiamano acidi e quelle che fanno aumentare la concentrazione di ioni OH- si dicono basi. Le soluzioni in cui la concentrazione di ioni H+ è più grande di quella degli ioni OH- si dicono acide; quelle in cui la concentrazione di ioni OH- è piè grande di quella degli ioni H+ si dicono basiche.
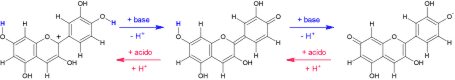 Inoltre, se il pH diviene molto alto, cioè la soluzione è molto basica si può avere un’altra reazione, e un cambiamento di colore ancora diverso. In definitiva, nelle soluzioni antocianine si possono verificare diversi cambiamenti di colore al variare del pH e questo fatto può essere sfruttato per stabilire, in base al colore osservato, se la soluzione sia acida o basica e valutare, in modo almeno approssimato, il valore del pH.
Inoltre, se il pH diviene molto alto, cioè la soluzione è molto basica si può avere un’altra reazione, e un cambiamento di colore ancora diverso. In definitiva, nelle soluzioni antocianine si possono verificare diversi cambiamenti di colore al variare del pH e questo fatto può essere sfruttato per stabilire, in base al colore osservato, se la soluzione sia acida o basica e valutare, in modo almeno approssimato, il valore del pH. 
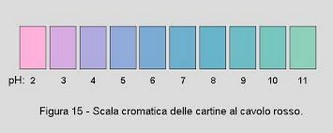
Il colore varia da rosso nelle soluzioni nettamente acide (pH intorno a 3) a viola-blu in quelle da poco acide a poco basiche (valori di pH compresi fra 5 e 8) e infine a giallo nelle soluzioni nettamente basiche (valori di pH maggiori di 8), con una possibile transizione attraverso il verde (giallo+blu).
Preparazione
Per approfondire
Scarica la scheda sul pH e gli indicatori (livello base) preparata di didascienze.it 
Cucina
Con il cavolo che avanza preparate qualche ricetta http://www.giallozafferano.it/ricerca-ricette/cavolo+rosso/
Crediti
Notizie sono state tratte dal Corso di laurea in Chimica dell'Università di Padova, la rubrica La scienze in cucina (Le Scienze) e da Fun Science








