Principio di indeterminazione - Didattica delle Scienze



Menu principale:
Principio di indeterminazione
Chimica > La fisica quantistica
Il Principio di indeterminazione di Heisenberg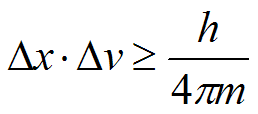
Tre video sul principio, molto dioversi tra loro. Uno serio e ben fatto sulla storia di Heisenberg e del principio da lui proposto, quindi una lezione on-line ed infine uno semiserio con dei cartoni, tratto dalla serie televiva SuperQuar.
... e ora un po' di formalizzazione matematica
Secondo il principio di indeterminazione è impossibile determinare con esattezza e simultaneamente la posizione e la velocità di un elettrone (e più in generale di una particella).
La forma matematica di queste principio è molto semplice. Se chiamiamo con Δx la posizione dell'elettrone e quindi con Δx l'indeterminazione della posizione, da quanto abbiamo detto si ricava che Δx è dell'ordine di grandezza della lunghezza d'onda del λ fotone, mentre, se chiamiamo con q la quantità di moto dell'elettrone (q=mv => q=Δmv) e quindi con Δq l'indeterminazione nella sua quantità di moto, si può facilmente vedere che anche Δq dipende da λ e, maggiore è l'energia trasportata dal fotone, maggiore è l'energia che questo scambia con l'elettrone. Più precisamente si avrà:
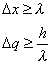
combinando queste due relazioni si trova:

Con altre considerazioni, che tralasciamo, la forma definitiva del principio di indeterminazione risulta essere:
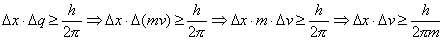
dove h la costante di Planck ed m la massa dell'elettrone.
Esempio del camion
Applichiamogli il principio di indeterminazione ad un camion e vediamo cosa succede. Supponiamo che un camion abbia una massa m = 10.000 Kg ed una velocità v ~ 10 m/s (= 36 Km/h). Supponiamo inoltre che l'indeterminazione sulla velocità sia Δv = 1 m/s (il che significa dire che la velocità del camion può variare del 10 % intorno al valore, di 10 m/s, dato). Calcoliamoci l'indeterminazione nella posizione del camion. Si ha:
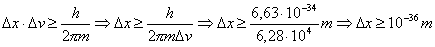
E' evidente che l'indeterminazione nella posizione è tanto piccola (si ricordi che le dimensioni atomiche sono dell'ordine di m) da non poter essere in alcun modo presa in considerazione.
Esempio del pallino di piombo
Facciamo ora lo stesso conto per un pallino di piombo da caccia di massa m = 1 mg (=10-3g=10-6Kg) e con velocità v ~ 100 m/s (=360 Km/h). Supponiamo che l'indeterminazione sulla velocità sia Δ v = 10 m/s (anche qui il 10% della velocità v). Si trova:
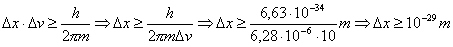
Anche in questo caso quindi questa indeterminazione è assolutamente ridicola ed al di fuori di ogni portata valutativa (in nessun modo è possibile rendersene conto).
Esempio dell'elettrone
Applichiamo infine il principio di indeterminazione ad un elettrone di massa m =9,1*10-31 Kg che si muove con una velocità v ~ 2.000.000 m/s (=2*10-6m/s). Supponiamo che l'indeterminazione nella velocità sia anche qui il 10% di Δv, cioè v =0,2*10-6 m/s. Per l'indeterminazione nella posizione (Δx) si trova:

In questo caso, come si può ben vedere, l'indeterminazione nella posizione è dell'ordine di grandezza delle dimensioni atomiche e non può quindi in nessun modo venire trascurata trattando questioni atomiche.
E' cioè impossibile dire dove si trova un elettrone all'interno di un atomo. Non si può quindi descrivere l'orbita di un elettrone all'interno di un atomo poiché la fascia di indeterminazione si rivela, in questo caso, larga quanto la distanza dell'orbita dal nucleo. Troviamo così che la meccanica quantistica non ci fornisce alcuna informazione sulla traiettoria seguita da un elettrone intorno al nucleo. Non potremo più parlare di orbite percorse dagli elettroni, che presuppongono sia valori finiti e ben determinati della distanza dal nucleo sia la conoscenza della posizione e della velocità dell'elettrone. In luogo di queste orbite dovremo considerare un certo volume (il cosiddetto orbitale atomico) entro cui e possibile o probabile che l'elettrone si trovi.
Ma oggi è ancora valido il Principio di indeterminazione?
L'effetto della misura sul sistema quantistico non è il cuore del problema: tali disturbi sono presenti anche nella fisica classica, mentre l'incertezza è radicata nella natura stessa delle particelle quantistiche, che non possono essere descritte come oggetti puntiformi con una ben definita velocità: si comportano come un'onda e per un'onda, la posizione e la quantità di moto non possono essere definite con precisione simultaneamente. La regola per cui quanto più piccolo è l'errore in una misura, tanto maggiore è l'imprecisione nelle altre, vale ancora. Ma il prodotto di errore e disturbo può essere reso arbitrariamente piccolo, anche più piccolo di quanto permetterebbe la formulazione originale di Heisenberg del principio di indeterminazione
Il principio di indeterminazione è naturalmente ancora valido, però l'incertezza non sempre proviene dall'influenza perturbatrice della misura, ma dalla natura quantistica della particella stessa. (Erhart, 2012)








